El origen y las funciones de los sueños a partir de los potenciales PGO
RESUMEN
El fenómeno del sueño y de los sueños es algo que siempre ha fascinado al hombre. Sin embargo, el estudio científico del sueño es relativamente reciente. En 1953, Aserinsky y Kleitman encontraron que el sueño de ondas lentas (SOL) es interrumpido periódicamente por episodios de actividad EEG rápida, que se acompañan de movimientos oculares rápidos (MORs), y denominaron a esta fase “sueño MOR”. Posteriormente, Dement y Kleitman, en 1957, descubrieron que estos movimientos oculares rápidos coinciden con la aparición de los sueños. Utilizando animales de experimentación se han estudiado los mecanismos subcorticales que subyacen al sueño MOR y se ha demostrado que éste depende de una actividad serotoninérgica de la vigilia, que promueve la formación de péptidos que ponen en marcha ciertas estructuras de la región pontina del tallo cerebral en donde se integran los mecanismos colinérgicos del sueño MOR. En la región pontina, a su vez, se generan potenciales monofásicos de alto voltaje (300-400 µV) que también pueden registrarse en el cuerpo geniculado lateral y en la corteza occipital, de allí el nombre de potenciales ponto-genículo-occipitales (PGO). Estos potenciales se propagan hacia el sistema oculomotor para provocar los MORs y posiblemente den origen a los fenómenos oníricos visuales. Además se ha demostrado que ciertas estructuras del sistema límbico, relacionadas con las emociones y la memoria, son activadas por dichos potenciales. Lo anterior sugiere que los potenciales PGO generan los componentes mnésicos y emocionales de los sueños. Quedan aún por determinarse varios aspectos sobre las funciones de estos potenciales, pero el conocimiento sobre el origen de los fenómenos cerebrales que generan los sueños ha tenido un gran avance a partir de su estudio. En el presente artículo se revisa la bibliografía concerniente a los trabajos realizados sobre los potenciales PGO y su aportación al conocimiento del origen y las funciones de los sueños.
Palabras clave: Sueños, PGO, conciencia.
“El sueño es el alivio de las miserias para los que las sufren despiertos…”
Miguel de Cervantes Saavedra.
INTRODUCCIÓN
Cuando dormimos, el 20% de este tiempo la pasamos soñando. Mientras dormimos, experimentamos involuntariamente episodios de actividad mental acompañados de percepciones sensoriales que nos evocan vivencias personales con un tono emocional. Pero ¿cuál es el origen de estos fenómenos y cuál es su función? ¿Para qué necesita nuestro cerebro estos episodios cada noche? Estas son interrogantes muy antiguas y, según la época o la cultura, los sueños se han entendido de diversas maneras. Los sueños han interesado a la humanidad desde épocas remotas. No tenemos o posiblemente no se han buscado indicios de la inquietud del hombre primitivo por los sueños. Con la aparición de la escritura reflexiva, tenemos las primeras noticias de este interés. Los sueños no sólo llamaban la atención de la gente sino que además eran utilizados para interpretar el porvenir. También han sido considerados como mágicos y místicos. Algunos brujos y/o chamanes los utilizaron y aún los usan, como un medio de comunicación con los dioses o con espíritus de sus antepasados. A fines del siglo XVIII y principios del XIX los sueños fueron empleados por adivinos y charlatanes, para predecir a la gente su suerte y fortuna. El éxito de esta práctica impulsó la publicación de libros donde el lector encontraba el significado de sus sueños, de acuerdo a una serie de símbolos esotéricos.
En esos siglos las ciencias médicas se ocuparon, a su vez, de la cuantificación de variables vegetativas durante el dormir. Se describió con exactitud la disminución progresiva de las frecuencias cardiaca y respiratoria, pero los médicos prestaron poca atención a los sueños, y por la complejidad de los cambios mentales que las acompañan las consideraron como fenómenos anormales, producto de un cerebro mal oxigenado. Sin embargo, el estudio científico de los sueños y el identificarlos como un estado fisiológico cerebral, es relativamente reciente, de hace unos 60 años.
BREVE HISTORIA DEL ESTUDIO DE LOS SUEÑOS
En 1862, Alfred Maury hace los primeros intentos por explicar la causa del contenido mental de los sueños. Propuso que éstos aparecen como actos reflejos a estímulos sensoriales del entorno. Actualmente hay datos que apoyan en cierta medida la proposición de Maury. En ocasiones un estímulo sensorial puede modificar su contenido, pero los sueños también ocurren en ausencia absoluta de estímulos externos. No obstante, hay que reconocer a Maury como pionero en la exploración de los fenómenos mentales de los sueños. Además, Maury describió la aparición de otro tipo de fenómenos perceptivos al inicio del sueño, a los que denominó alucinaciones hipnagógicas y que distinguió de los sueños por su brevedad y contenido poco elaborado.1
Más tarde, Sigmund Freud se basó en el contenido de los sueños para elaborar su teoría acerca de los procesos del pensamiento, que propuso como útil en el tratamiento de enfermedades nerviosas. Freud distinguía dos componentes principales de los sueños: el contenido manifiesto (expresado por el paciente) y el contenido latente o subconsciente, que era inferido por Freud, de acuerdo a una simbología sexual.2,3 Más tarde propuso que los sueños ocurren como un continuo durante el dormir o durante la transición del dormir al despertar. Actualmente sabemos que el soñar no es un continuo, pero la segunda proposición se justifica porque los sueños que generalmente recordamos son aquellos que nos producen el despertar. De esta forma se logra apreciar que sólo era tomado en cuenta el aspecto mental de los sueños sin que hubiera un interés sobre la relación que guardan con un estado funcional del cerebro.
Fue en el año de 1929 cuando Hans Berger desarrolló el método del electroencefalograma (EEG), haciendo posible el registro de la actividad eléctrica cerebral en el hombre. Esto permitió establecer una relación directa entre los estados de conciencia y la actividad electrofisiológica del cerebro. El mismo Berger demostró que durante el estado de alerta aparecen ritmos EEG rápidos, de bajo voltaje y que al iniciarse el sueño aparecen ritmos lentos y de alto voltaje.4,5 Esto llevó a otros investigadores a clasificar al sueño en cuatro estadios (A, B, C y D), según la proporción de ondas lentas que aparecieran.6 Sin embargo todavía no se tenían indicios de la relación entre los sueños y un estado particular del sueño.
EL DESCUBRIMIENTO DEL SUEÑO MOR EN EL HOMBRE
En 1953, Aserinsky y Kleitman encontraron que los ritmos lentos y de alto voltaje (sueño de ondas lentas: SOL), son interrumpidos periódicamente por episodios de actividad EEG rápida, que se acompañan de movimientos oculares rápidos.7 A estos episodios los denominaron sueño de movimientos oculares rápidos (MOR). Posteriormente, Dement y Kleitman descubrieron un fenómeno de gran importancia: que los movimientos oculares rápidos (MORs) de esa fase coinciden con la aparición de los sueños.8,9 Por primera vez se sabía con exactitud en qué momento ocurrían y, además, que estaban ligados a un estado fisiológico cerebral específico. Este descubrimiento dio comienzo a una nueva etapa en el estudio de los sueños en la cual se realizarían análisis sistematizados sobre ellos dentro del campo de las neurociencias.
La posibilidad de recolectar reportes verbales de varios sueños durante una noche favoreció numerosas investiga-
ciones que caracterizaron sus componentes mentales y se hicieron intentos por relacionarlos con diferentes variables biológicas.10,11 Por ejemplo, se encontró una relación entre los sueños y la aparición de un número elevado de MORs. Asimismo se observó la coincidencia de salvas de MORs de gran amplitud con sueños de contenido emocional intenso, es decir, sueños angustiantes, vívidos, con mayor número de personajes, escenas e historias elaboradas.12-14 También se relacionó la aparición de los sueños con modificaciones de la resistencia eléctrica de la piel y con cambios repentinos de las frecuencias cardíaca y respiratoria.15
Mecanismos de integración cerebral del sueño MOR
Es indudable que el descubrimiento del sueño MOR en el hombre favoreció el conocimiento de la estructura mental de los sueños, su relación con un estado fisiológico cerebral y con diversos cambios periféricos. Sin embargo, debido a la imposibilidad de explorar el cerebro humano a profundidad, no se obtuvieron en ese momento datos acerca de los mecanismos subcorticales que subyacen al sueño MOR y a los sueños. Esto solamente ha sido posible mediante el uso de animales de experimentación en los que se han estudiado los mecanismos subcorticales que subyacen al sueño MOR y se ha demostrado que esta fase está regulada por factores humorales de origen peptídico. El sueño MOR depende de una actividad serotoninérgica presente en la vigilia, que promueve la formación de péptidos hipotálamo-hipofisiarios que ponen en marcha las estructuras de la región pontina del tallo cerebral, donde se integran los mecanismos del sueño MOR.16-20
En la región pontina se localizan varios núcleos celulares que generan los diferentes componentes del sueño MOR. Del locus coeruleus emergen fibras que hacen relevo en los núcleos reticularis pontis oralis y reticularis pontis caudalis,21 para llegar a las astas ventrales de la médula espinal, donde los impulsos nerviosos que viajan por ellas provocan la hiperpolarización de las motoneuronas y con ello la inhibición del tono muscular.22,23
Los núcleos reticularis pontis oralis y reticularis pontis caudalis también participan en la activación cortical del sueño MOR.21 La acetilcolina juega un papel primordial en la generación del sueño MOR. La activación colinérgica del campo tegmental gigantocelular (CTG) produce la pronta (5-7 min) instalación de episodios prolongados de sueño MOR.24-27 Asimismo, la activación colinérgica del peri-locus coeruleus induce la instalación de esta fase del sueño.28,29
Otro fenómeno neurofisiológico del sueño MOR es la atonía muscular. Los sueños son episodios alucinatorios que aparecen espontáneamente y de manera involuntaria. En ocasiones contienen conductas motoras volitivas, que si pudieran efectuarse pondrían en peligro la integridad física o social del organismo. Probablemente con fines homeostásicos, la naturaleza nos ha provisto de un mecanismo que suprime la actividad muscular durante los sueños. Este mecanismo se integra en el tallo cerebral y la médula espinal.22,23 En resumen, la atonía muscular provoca un estado de inmovilidad probablemente para la restauración del sistema muscular antigravitatorio y para evitar la expresión motora de los sueños, y la activación cortical propicia un estado particular de conciencia sobre el cual irrumpen intermitentemente fenómenos alucinatorios (oníricos), incluso de actividad motora y de percepción de movimiento.
Origen y propagación de los potenciales PGO
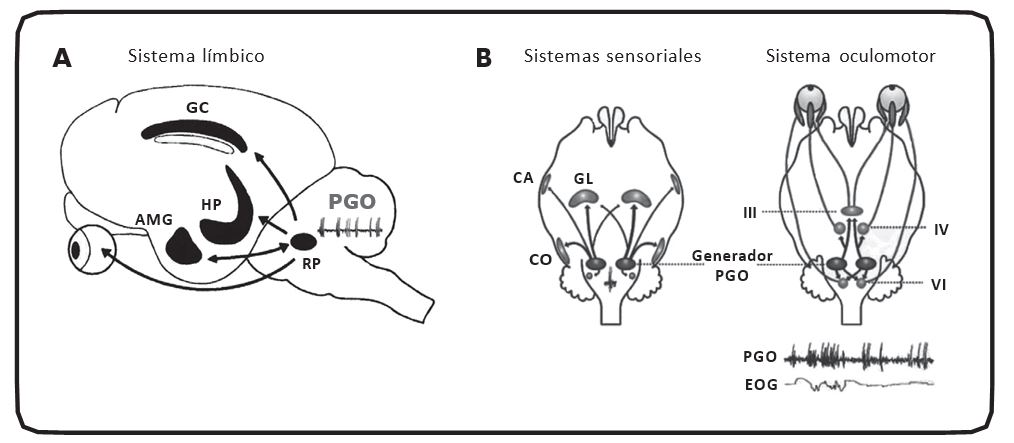
Durante el sueño MOR, en la región pontina, específicamente en la región peribraquial (PBL), se generan de manera intermitente unos potenciales monofásicos de alto voltaje (300 a 400 µV),30 que también pueden registrarse en el cuerpo geniculado lateral31 y en la corteza occipital del gato.32 De esta distribución anatómica, donde fueron registrados inicialmente, se derivó el nombre de potenciales fásicos Ponto-Genículo-Occipitales (PGO′s)33 (figura 1). Los potenciales PGO no se presentan aleatoriamente en el cuerpo geniculado y en la corteza occipital, sino que se generan en la región pontina y se propagan hacia el sistema visual.34,35 Esto señala que los potenciales PGO viajan hacia regiones del cerebro anterior para activarlas o modificar su actividad de manera intermitente. Los potenciales PGO también se propagan hacia los núcleos de relevo talámicos y la corteza del sistema auditivo,36 así como al sistema oculomotor para provocar los MORs de esa fase del sueño. Es importante mencionar que estos potenciales no se generan de manera simultánea en ambas PBLs. Estos potenciales pueden ser generados ya sea en el PBL izquierdo o en el derecho, así es que ocurren de manera indistinta. Hasta el momento se desconoce si es que se generan más de un lado o del otro (figura 1).37,38
Propagación hacia el sistema límbico
Se ha demostrado que ciertas estructuras del sistema límbico (SL) son activadas por los potenciales PGO. El SL juega un papel importante en los procesos de consolidación de la memoria. Además es una parte estratégica en la asociación de elementos sensoriales y emocionales, lo que permite la formación de los elementos cognitivos de la actividad mental durante la vigilia. Lo anterior permite suponer que las emociones, las reminiscencias personales, los fenómenos alucinatorios y los cambios vegetativos de los sueños son integrados en estas estructuras.39-42 A continuación nos vamos a referir a tres regiones límbicas en especial: el giro del cíngulo, el hipocampo y la amígdala del lóbulo temporal.
Giro del cíngulo
Esta estructura interviene en la integración emocional de la información sensorial proveniente de los núcleos de relevo talámicos.43 Con la estimulación eléctrica del giro del cíngulo en animales se provoca la interrupción de la conducta motora que se halla en proceso; los animales denotan sorpresa, ansiedad y también aparecen respuestas viscerales.44 En el hombre, la estimulación eléctrica del giro del cíngulo provoca fenómenos oníricos complejos, cambios emocionales, movimientos oculares rápidos y la sensación de estar soñando.45,46
Figura 1. Generación y propagación de los potenciales PGO. A. En las estructuras del sistema límbico, como el giro del cíngulo (GC), el hipocampo (HP) y la amígdala (AMG) del lóbulo temporal, se integran funciones relacionadas con la emoción y la memoria. Estas estructuras son activadas fásicamente por los potenciales ponto-genículo-occipitales (PGO), generados en la región pontina del tallo cerebral (RP) durante el sueño MOR. Lo anterior sugiere que dicha activación genera sus componentes mnésicos y emocionales. B. Estos potenciales también se propagan hacia sistemas sensoriales como la corteza auditiva (CA), corteza occipital (CO) y cuerpo geniculado lateral (GL). Probablemente esta activación genere los componentes auditivos (e.g. lenguaje y conversaciones) y los fenómenos visuales (e.g. colores, formas, personajes, caras, lugares, objetos y animales). Sin embargo, se ha sugerido que el soñar se encuentra estrechamente relacionado con la imaginación, más que con la percepción. Es importante mencionar que estos potenciales también activan a los núcleos del III, IV y VI pares craneales generando el componente motor, produciéndose así los MORs que son registrados en el electrooculograma (EOG).
Hipocampo
El hipocampo se distingue de otras estructuras límbicas por presentar una actividad EEG theta (de cinco a siete ciclos por segundo), que ocurre de manera ininterrumpida durante el sueño MOR.47 Este ritmo theta abarca más regiones hipocámpicas y es discretamente más rápido que durante el estado de vigilia. En animales despiertos, el ritmo theta hipocámpico aparece en brotes y está asociado a conductas de orientación y desplazamiento hacia un estímulo significativo.48,49 Por otro lado, el ritmo theta hipocámpico también se asocia con el procesamiento, almacenamiento y evocación de la memoria.50 Es posible que durante el sueño MOR el ritmo theta hipocámpico sea un indicio de los fenómenos mnésicos de los sueños y, por otra parte, un signo de la orientación hacia un fenómeno perceptual al interior de éstos. El hipocampo también integra el tono emocional de la información sensorial talámica. Su estimulación eléctrica en animales provoca reacciones de defensa y de ataque. También se han observado cambios respiratorios y pupilares al estimular el hipocampo y su lesión disminuye el umbral a las reacciones emocionales (furia y conducta emocional exagerada).51-53 La estimulación
eléctrica del hipocampo en el hombre provoca la detención respiratoria y una concomitante psíquica reportada como sueños elaborados por los pacientes.54,55
Amígdala del lóbulo temporal
El papel de la amígdala en la conducta emocional e instintiva ha sido demostrado por numerosos investigadores. Su lesión o estimulación eléctrica provoca hipersexualidad, ansiedad, agresividad, conductas de huída y de ataque, dependiendo del núcleo amigdalino lesionado o estimulado. Esta estructura recibe información visual, auditiva, somestésica y visceral, proveniente de los núcleos talámicos de relevo y del tallo cerebral.56-59 Asimismo, la estimulación amigdalina produce cambios pupilares, variaciones de la presión arterial y de la frecuencia cardíaca.60 La estimulación eléctrica amigdalina en pacientes provoca la sensación de miedo o temor.61 A la fecha existe suficiente evidencia que demuestra que la amígdala forma parte de los circuitos neuronales involucrados en la modulación del sueño MOR. En estudios en pacientes con epilepsia del lóbulo temporal, los cuales presentan estados de excitabilidad aumentada en las regiones amigdalinas e hipocámpicas, se ha encontrado un aumento del sueño MOR en las noches que estos pacientes presentan descargas paroxísticas.62,63 Esto apoya la hipótesis de que las estructuras límbicas participan en la inducción del sueño MOR, un estado fisiológico necesario para el cerebro. Sin embargo, es de interés hacer notar que en estos pacientes el número de MORs se encuentra disminuido lo cual sugiere que la actividad paroxística no necesariamente
promueve otros componentes del MOR. Nosotros proponemos que la epilepsia puede inhibir los MORs y, por lo tanto, a los potenciales PGO. Aún queda por explorar la función de otras regiones límbicas durante el sueño MOR, pero es claro que el giro del cíngulo, el hipocampo y la amígdala presentan cambios fisiológicos relacionados a la propagación de los potenciales PGO. Actualmente se desconoce la participación de la ínsula (dolor), el septum (reforzamiento, conductas placenteras) y del núcleo accumbens, estructuras que por sus características funcionales, pensamos que podrían participar en la integración sensorial de los sueños.
Neuropsicofisiología de los sueños a partir de los potenciales PGO
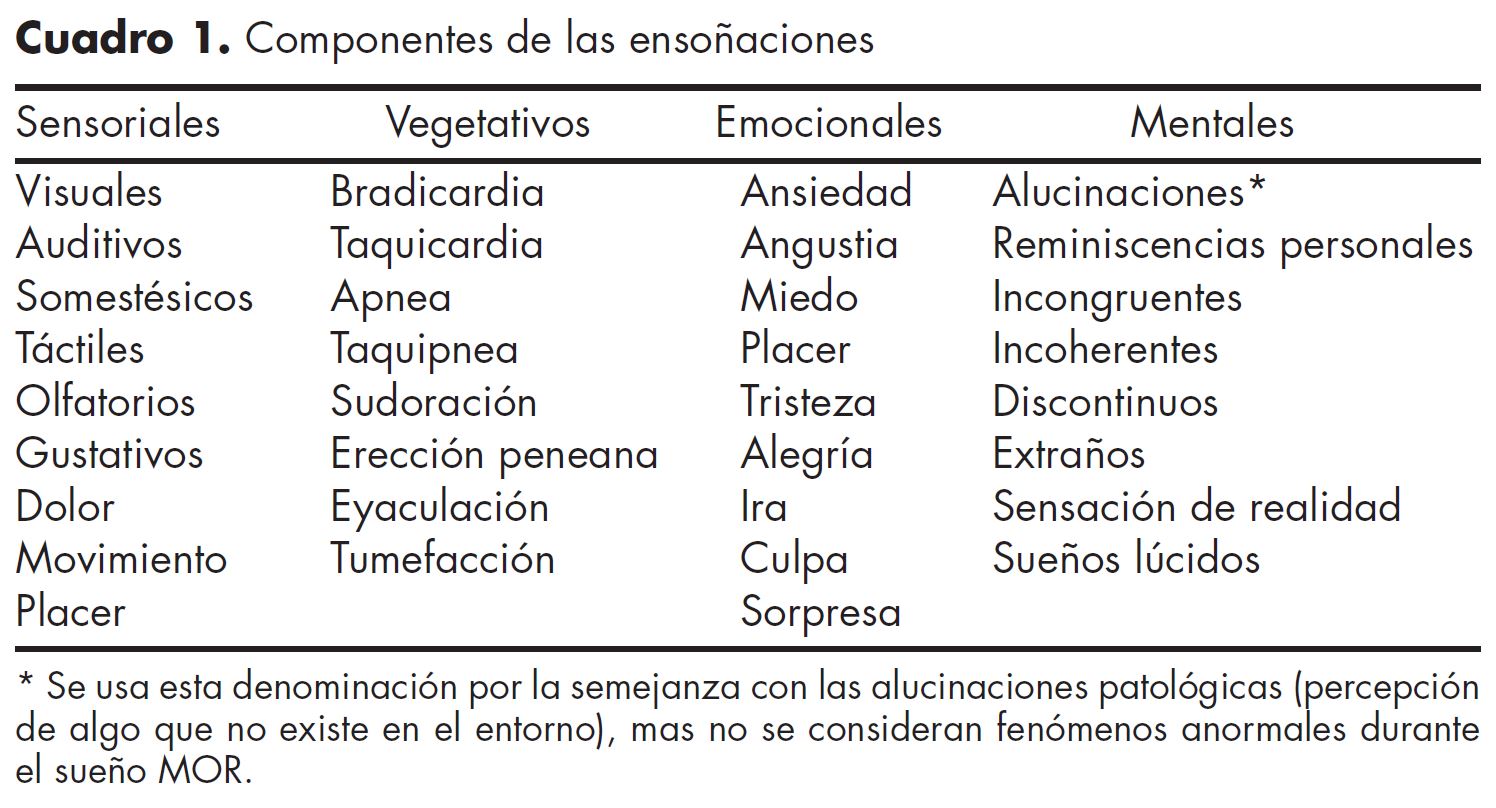
Los hallazgos relacionados a los potenciales PGO en el gato despertaron el interés por analizar su probable existencia en el ser humano. Varios investigadores han demostrado en el hombre la presencia de potenciales corticales equivalentes a los potenciales PGO del gato. Además han señalado que estos potenciales son indicativos de un cierto tipo de actividad mental.64-67 A partir de la exploración de los sueños en el hombre se ha logrado determinar que éstos se conforman por diversos componentes sensoriales, vegetativos, emocionales y mentales (cuadro 1).
Componentes sensoriales
En el hombre, como en el gato, el sueño MOR se acompaña de una actividad cortical desincronizada y de bajo voltaje, semejante a la observada durante el estado de vigilia. La activación cortical durante el sueño MOR indica que el cerebro está en condiciones de llevar a cabo cierta actividad mental en el hombre, o bien, de tener un estado peculiar de “conciencia” en los animales. La activación cortical durante la vigilia se debe a un efecto excitatorio proveniente de la formación reticular del tallo cerebral y del mesencéfalo.68 Durante el sueño MOR algunas regiones de la formación reticular del tallo cerebral, como el núcleo reticularis pontis oralis y el núcleo reticularis pontis caudalis, también ejercen una excitación sobre la corteza.69 Con base en lo anterior, los fenómenos sensoriales de los sueños podrían explicarse en parte por la propagación de los potenciales PGO hacia los sistemas sensoriales. Asimismo, los fenómenos vegetativos que acompañan a los sueños pueden generarse en parte por la activación fásica de los núcleos pontinos donde se regulan. En nuestro laboratorio, además de estos fenómenos hemos analizado la actividad de diferentes grupos musculares de la cara durante los episodios de sueño MOR. Hemos encontrado que el músculo frontalis y el músculo zigomático presentan activaciones importantes durante los sueños. Probablemente estas activaciones tengan relación con la cualidad o modalidad emocional de los sueños y con su contenido.70
Los cambios electrofisiológicos del hipocampo y la amígdala durante el sueño MOR indican la activación de estas regiones durante los fenómenos fásicos que acompañan a los sueños. Es bien conocido que el hipocampo y la amígdala intervienen en la consolidación de la memoria. Por consiguiente, es probable que los potenciales PGO promuevan cambios en sus neuronas para favorecer la fijación de memorias a largo plazo. La estimulación eléctrica breve de la formación reticular durante el estado de vigilia provoca en el gato un estado de “hiperalerta” que se acompaña de una reacción de orientación. Durante el sueño MOR71 la formación reticular está sometida a activaciones intermitentes producidas por las células generadoras de potenciales PGO, que pueden compararse con los estímulos eléctricos que desencadenan una reacción de orientación durante la vigilia.
Se ha propuesto que los componentes psíquicos sensoriales de los sueños son producidos por la propagación de los potenciales PGO hacia los sistemas visual y auditivo. Sin embargo, Penfield y Rasmussen72 y Penfield y Jasper61 demostraron que la estimulación eléctrica de las vías sensoriales primarias (visual y auditiva), en pacientes conscientes, solamente provoca fenómenos perceptuales elementales como colores, sombras, contornos, etc. en el caso de la vía visual, y ruidos y zumbidos en el caso de la vía auditiva. Esto último apoya la idea de que los fenómenos psíquicos elaborados de los sueños se integran en el sistema límbico, cuya estimulación eléctrica produce fenómenos alucinatorios y emocionales elaborados, además de la sensación de estar soñando.
Durante el sueño MOR la activación de los sistemas sensoriales no proviene del medio ambiente, sino de la región pontina donde se generan los potenciales PGO. Éstos “invaden” a las vías sensoriales de manera intermitente, bien sea como potenciales aislados o bien en salvas hasta de 10 o más potenciales. A su vez, los potenciales PGO se generan asincrónicamente, es decir existe una diferencia temporal (aproximadamente ocho a 12 milisegundos) entre los potenciales generados en un lado de la región pontina y los generados en el lado contralateral.37,38,73 Esto muestra que la activación de las vías sensoriales, de las cortezas de asociación y de las estructuras límbicas de un hemisferio, es asincrónica con respecto a la activación de las estructuras homólogas del hemisferio contralateral. Además, su activación es abrupta y a la vez discontinua. El hecho de que los hemisferios cerebrales se activen de manera intermitente y asincrónica durante el sueño MOR puede explicar, en cierta medida, el carácter incoherente e incongruente de los sueños, en los que una percepción sensorial no corresponde con un tono emocional dado, o bien, donde una reminiscencia personal no se desarrolla en el espacio y el tiempo que “normalmente” le correspondería. Por otro lado, lo discontinuo de los sueños puede estar dado por el carácter fásico de los potenciales PGO. Estos aparecen y desaparecen repentinamente. Probablemente esto provoca la aparición de un episodio onírico breve y la ocurrencia de una nueva salva de potenciales PGO provoca otro episodio diferente. Con respecto a lo anterior, aún no se ha documentado si durante un episodio de sueño MOR ocurren uno o varios sueños. Además, si ocurren más de uno, resultaría muy difícil definir dónde terminaría el primero y dónde comenzaría el subsiguiente. Todos estos fenómenos le pueden conferir una sensación de extrañeza al aspecto cognoscitivo de la actividad mental durante los sueños.
Se ha propuesto que los componentes visuales y auditivos de los sueños se originan por la propagación de los potenciales PGO hacia los sistemas visual y auditivo. Lo mismo podría pensarse de los componentes somestésicos y tactiles, ya que la actividad del 70% de las neuronas corticales se modifica en relación a los potenciales PGO y en varios núcleos talámicos se registran potenciales relacionados a los PGO. Sin embargo, aún es necesario analizar con precisión los cambios de las estructuras encargadas de la propiocepción durante el sueño MOR y su relación con los potenciales PGO. Acerca del origen de los fenómenos olfatorios y gustativos, todavía no se cuenta con datos que indiquen su integración cerebral durante el sueño MOR. Sin embargo, es de interés mencionar que mientras que las percepciones olfatorias son muy comunes, las gustativas raramente son reportadas. Por último, aún existen discrepancias acerca de la sensación de dolor durante los sueños, sin embargo existen datos que sugieren que ésta sí se presenta aunque no de manera común.74
Componentes emocionales
Normalmente los sueños están compuestos principalmente por reminiscencias personales, mientras que las reminiscencias conceptuales están prácticamente ausentes. Además de esto se sabe que la estimulación de estructuras límbicas provoca exclusivamente reminiscencias de tipo personal. Probablemente durante el sueño MOR el sistema límbico contribuye a la consolidación de memorias de vivencias personales, más que de conceptos, cuya memorización requiere de una atención selectiva como la del estado de vigilia. La reprogramación de conductas instintivas genéticamente predeterminadas (alimentación, reproducción, anidación, ataque, huída, impronta, etc.) es otra de las funciones propuestas para el sueño MOR.17 Esta hipótesis se basa en que las neuronas son células que no se reproducen y que para mantener su función a lo largo de la vida es necesario que sean reprogramadas en algún momento. Esta reprogramación se llevaría a cabo durante el sueño MOR y la activación fásica del cerebro por los potenciales PGO sería la responsable de esta reprogramación. El sistema límbico interviene en la integración de algunas conductas instintivas como la alimentación, la reproducción, el ataque y la huída, además es activado por los potenciales PGO durante el sueño MOR. En este sentido, es posible que las estructuras límbicas sean el sitio donde se reprogramen las funciones instintivas.
Por otra parte, los sueños parecen proteger y/o promover el curso de la fase MOR del sueño. Los MORs aparecen cuando el umbral al despertar está más elevado. Este fenómeno se explica por la inhibición que ejercen los potenciales PGO sobre la información sensorial aferente. Por ejemplo, los potenciales PGO bloquean, a nivel del cuerpo geniculado, los impulsos nerviosos provenientes del nervio óptico, obstaculizando la llegada de la información visual a la corteza.73 Por otra parte, si privamos a un animal o a una persona de sueño MOR, por varias horas o días, la tasa perdida de esta fase del sueño tiende a recuperarse en un 65 a 70% y es de interés hacer notar que los MORs y los potenciales PGO perdidos se recuperan hasta en un 90%, respectivamente.74-76 Esto le confiere al sueño MOR y a los potenciales PGO la característica de ser fenómenos necesarios para el cerebro. Pudiera entonces pensarse que los sueños (ligados al MOR y a los potenciales PGO) también están reguladas a largo plazo y que son fenómenos necesarios para el cerebro. El hecho de que los sueños sean más vívidos y con un contenido emocional más intenso durante la recuperación del sueño MOR, apoya esta idea.11
FUNCIONES DE LOS SUEÑOS
Distintos autores han propuesto que el sueño MOR es un estado necesario para la consolidación de la memoria de corto y de largo plazo, ya que la privación del sueño MOR provoca fallas y errores en la memoria y por lo tanto también del aprendizaje.77-81 Por otra parte, las tareas de aprendizaje incrementan el sueño MOR y el número de MORs durante dos a tres días posteriores a la realización de la tarea, tanto en animales como en el hombre.82,83 Desde un punto de vista neurofisiológico aún es difícil explicar la sensación de extrañeza, lo discontinuo y lo incoherente e incongruente de los sueños. Sin embargo, estas características de los sueños pueden señalar una falta de sincronía entre ambos hemisferios cerebrales para integrar una actividad mental coherente y congruente. En el estado de vigilia la información sensorial “invade” de manera continua y simultánea a ambos hemisferios cerebrales. Cuando hay alguna alteración entre la comunicación interhemisférica, como es el caso del cerebro escindido,84 una persona puede ver un objeto con el ojo izquierdo pero no es capaz de nombrarlo, y si lo observa con el ojo derecho reconocerá su nombre pero no le imprime un componente afectivo y espacial. Estas situaciones pueden causar en el sujeto la sensación de extrañeza ante el estímulo externo pues no le es fácil reconocerlo.
DISCUSIÓN
En base a toda la información aquí presentada podemos decir que existe suficiente evidencia que apoya la idea de que los potenciales PGO son las activaciones neuronales responsables de la generación de la mayor parte de los componentes psicofisiológicos de los sueños y, probablemente, estén involucrados también en el cumplimiento de las funciones bio-psicológicas del sueño MOR. La activación de estructuras límbicas y corticales por la propagación de los potenciales PGO apoya esta idea. Vemos entonces que los sueños no sólo representan la serie de fenómenos mentales que tanto han intrigado al hombre desde tiempos remotos por su impacto en la vida cotidiana, sino que también son signos de diversos cambios neuropsicológicos que son el resultado de la activación de extensas redes y conjuntos neuronales, cuyo disparo inicial es la actividad de los potenciales PGO. Quedan aún por determinarse varios aspectos sobre las funciones de estos potenciales, pero el conocimiento sobre el origen de los fenómenos cerebrales que generan los sueños ha tenido un gran avance a partir de su estudio.
Cierto es que el ser humano comunica verbalmente sus experiencias oníricas, pero los cambios cerebrales que las acompañan los experimenta desde antes de adquirir el habla. Por lo tanto, los datos colectados mediante el estudio científico del sueño y los sueños señalan un paradigma para la exploración biológica de la función de los sueños, cuyos componentes mentales y perceptuales posiblemente representan un epifenómeno de procesos homeostásicos y vitales para el individuo.
Hobson asegura que pueden tener una función creativa al proporcionar un modelo de realidad virtual (protoconciencia). Funcionalmente, el cerebro se prepara asimismo
para funciones integrativas, incluido el aprendizaje y la conciencia secundaria. La activación de la corteza cerebral durante el MOR puede remitir a algún tipo de conciencia primaria (protoconciencia) y a una conciencia secundaria (metacognición).85 De acuerdo con lo anterior, el sueño no representa un estado alterado de conciencia sino un estado de conciencia diferente al de la vigilia. Por otra parte, fenómenos comunes dentro de los sueños son los tiempos, lugares y personas que cambian sin previo aviso, y las interacciones sociales. Regularmente el soñador es el personaje activo. Hay memorias episódicas autobiográficas, secuencia de eventos, discontinuidad e incongruencia en la trama. Siempre está presente la sensación de movimiento y el 80% de los incidentes resultan tener el carácter de ser eventos novedosos, sólo el 20% tiene fuentes de memoria identificables. Hay pérdida gradual de la orientación dentro de las escenas, a veces no se puede reconocer la continuidad entre ellas.
Frecuentemente el reconocimiento de personajes no es confiable/exacto, pero el soñador difícilmente se da cuenta de los errores. Sin embargo actualmente se ha propuesto que incluso durante los sueños podemos adquirir o presentar la llamada “teoría de la mente”, debido a que el soñador reconoce los procesos mentales de otros personajes presentes en su sueño. Además de esto, el pensamiento puede llegar a ser lógico, aunque la mayor parte no es racional.
Con respecto al recuerdo de los sueños, aún siguen existiendo contradicciones acerca del por qué, a veces, recordamos nuestros sueños y otras no. La explicación fisiológica del recuerdo tiene que ver con la cercanía temporal entre la ocurrencia de episodio MOR y el despertar. Es importante entender además que la calidad de estos despertares no siempre es la misma, debido a que en nuestros múltiples despertares nocturnos no siempre se alcanzan los mismos niveles de conciencia.
Sin embargo, en términos de funcionalidad se ha propuesto que no necesariamente tenemos por qué recordar nuestros sueños. Aunque no esté presente el recuerdo, la experiencia psíquica ya tuvo lugar y ya debe haber cumplido sus funciones, sobre todo en términos de aprendizaje, memoria y aspectos emocionales. En general, podemos hablar de una “amnesia” de nuestros sueños. Ésta se debe a que durante el MOR la corteza prefrontal dorsolateral es desactivada, y por lo tanto esta fase del sueño crea un estado cerebral que no es favorable para la memoria subsiguiente.11,85 En contraste, si comparamos el nivel de recuerdo de sujetos control (sanos) con el de personas con estrés-postraumatico, pacientes con depresión mayor y con epilepsia del lóbulo temporal, por ejemplo, el número de recuerdos resulta ser mayor en estos últimos. En el mismo sentido resultan ser más vívidos, más angustiantes y más desagradables, además de repetitivos. El que estos pacientes reporten experimentar sueño más a menudo, puede deberse a que sus sueños tienen una mayor carga emocional (por lo regular negativa) y en este sentido se ha propuesto que un mayor o mejor recuerdo de los sueños puede presentarse cuando existen alteraciones neurológicas y/o psiquiátricas. Por lo tanto, se ha sugerido que un pobre recuerdo puede deberse a una menor carga emocional de tipo negativo.
¿Durante los sueños tenemos una conciencia similar a la de la vigilia? De acuerdo con Freud3 y Solms,86 no, debido a que el aspecto de los sueños es extraño e incluye cambios sin sentido en tiempo y lugar, así como incongruencias de la trama, de los personajes y de las acciones. Esto es porque el contenido verdadero del sueño es enmascarado por el soñante. De acuerdo a lo anterior, estos autores proponen que soñar puede ser muy afín a la enfermedad mental. La visión de Hobson también apoya esta idea. Para él, soñar puede ser comparable al delirium (estado de confusión agudo) que puede ocurrir durante el síndrome de abstinencia al alcohol. También propone que el sueño MOR comparte sus sustratos fisiológicos con los de las condiciones psicopatológicas, tales como la esquizofrenia, la cual se caracteriza por una hiperactivación límbica y por una hipo-activación frontal.11 Por el contrario, las teorías de Foulkes10 y Domhoff87 apoyan la idea que es posible que los sueños sean “una réplica muy fiel de la vida en vigilia”, que en gran medida son coherentes y con una secuencia narrativa interna posible, en lugar de secuencias ilógicas estereotipadas de imágenes extrañas o incongruentes. El análisis del contenido indica una fuerte continuidad entre el contenido del sueño y lo que sucede durante la vigilia. La evidencia que une a los sueños con la psicosis es limitada.
Nosotros pensamos que una de las funciones principales de los sueños es la de crear una “realidad virtual” que nos prepare para situaciones probables de nuestra vigilia siguiente. Esta creación de un mundo y situaciones virtuales nos prepara para cualquier eventualidad o para la solución de problemas que tengan que ver con la cotidianeidad. Un ejemplo de esto pueden ser las situaciones sociales, laborales y familiares que sucedan dentro de la conducta onírica. Esta “realidad virtual” provee un modelo del mundo que resulta funcional para el desarrollo y mantenimiento de la conciencia durante la vigilia. Nosotros incluso proponemos que durante nuestros sueños somos capaces de crear nuestro propio “avatar”, y al mismo tiempo los de los personajes que aparecen en las mismas. Nos referimos al término “avatar” no en el sentido divino, sino más bien en el concepto moderno. Este término empezó a ser usado en el sentido iconográfico por los diseñadores de varios juegos de rol, tales como Habitat, en 1987, o Shadowrun, en 1989, y es comúnmente empleado en internet. La palabra avatar se asocia con la representación gráfica mediante un dibujo o la fotografía de una persona para su identificación. Algunas tecnologías permiten también el uso de avatares en tres dimensiones. Finalmente queremos agregar que la realidad virtual creada durante nuestros sueños no difieren del todo de nuestra vida real y cotidiana, que las cosas que soñamos tienen que ver directamente con todas nuestras experiencias y situaciones de la vigilia consciente. La función principal de los sueños sería entonces el simular eventos que pudieran ocurrir realmente y así tener una “experiencia previa” que nos otorgue ventajas funcionales en términos bio-psíco-sociales, aunque no exista consciencia de ello.
REFERENCIAS
- Maury Le sommeil et le rêve. París: Didier et Cie; 1862.
- Freud Introduction à la psychanalyse. Paris: Payot; 1924.
- Freud S (1900a) Obras completas. “Los sueños”. Buenos Aires; Amorrortu;
- Berger Über das elektroencephalogramm des Menschen. Arch Psychiatr Nervenkr 1929;87:527-570.
- Berger Über das electroenkephalogram des Menschen. Zweite Mitteilung. J Psych Neurol 1930;40:160-179.
- Loomis A, Harvey E, Hobart Cerebral states during sleep as studied by human brain potentials. J Exp Psychol 1937;21:127-44.
- Aserinsky E, Kleitman N. Regularly ocurring periods of eye motility and concomitant phenomena during sleep. Science 1953;118:273-274.
- Dement WC, Kleitman N. Cyclic variations in EEG during sleep and their relation to eye movements, body motility and Electroenceph Clin Neurophysiol 1957a;9:673-690.
- Dement WC, Kleitman N. The relation of eye movement during sleep to dream activity. J Exp Psychol 1957b;53:339-346.
- Foulkes The psychology of sleep. New York: Scribner; 1966.
- Hobson The dreaming brain. Boston: Harper-Collins Pub.; 1988.
- Dement WC, Wolpert The relation of eye movements, body motility and external stimuli to dream content. J Exp Psychol 1958;55:543-553.
- Berger RJ, Oswald I. Eye movements during active and passive dreaScience 1962;137:601.
- Goodenough D, Lewis HB, Shapiro A, Sleser I. Some correlates of dream reporting following laboratory awakenings. J Nerv Ment Dis 1965;140:365-373.
- Orem J, Barnes CD. Physiology in sleep. New York: Academic Press;
- Cespuglio R, Gomez ME, Walker E, Jouvet M. Effets du refroidissement et de la stimulation des noyaux du système du raphé sur les états de vigilance chez le Electroenceph Clin Neurophysiol 1979;47:289-308.
- Jouvet Neuromédiateurs et facteurs hypnogènes. Rev Neurol 1984;140:389-400.
- Chastrette N, Cespuglio R, Jouvet M. Proopiomelanocortin (POMC) derived peptides and sleep in the Part 1. Hypnogenic properties of ACTH derivates. Neuropeptides 1990;15:61-74.
- Houdouin F, Cespuglio R, Jouvet M. Effects induced by the electrical stimulation of the nucleus raphe dorsalis upon hypothalamic release of 5hydroxyindole compounds and sleep parameters in the Brain Res 1991;565:48-56.
- Morin AJ, Denoroy L, Jouvet M. Effect of paradoxical sleep deprivation on vasoactive intestinal peptide-like immunoreactivity in discrete brain areas and anterior pituitary of the Brain Res Bull 1992;28:655661.
- Sakai K. Anatomical and physiological basis of paradoxical sleep. En: McGinty DJ (ed.). Brain mechanisms of New York: Raven Press; 1985; pp.111-137.
- Morales FR, Boxer P, Chase MH. Behavioral state-specific inhibitory postsynaptic potentials impinge on cat lumbar motoneurons during active sleep. Exp Neurol 1987;98:418-435.
- López-Rodríguez F, Chase MH, Morales PGO-related potentials in lumbar motoneurons during active sleep. J Neurophysiol 1992;68:109116.
- Vivaldi E, McCarley RW, Hobson JA. Evocation of desynchronized sleep signs by chemical microstimulation of the pontine brainstem. En: Hobson JA, Brazier MAB (eds.). The reticular formation revisited. New York: Raven Press; 1980.
- Baghdoyan HA, Rodrigo-Angulo ML, McCarley RW, Hobson Sitespecific enhancement and suppression of desynchronized sleep signs following cholinergic stimulation of three brainstem regions. Brain Res 1984;306:39-52.
- Yamamoto K, Mamelak AN, Quattrochi J, Hobson JA. A cholinoceptive desynchronized sleep induction zone in the anterodorsal pontine tegmentum: locus of sensitive region. Neuroscience 1990a;39:279-
- Yamamoto K, Mamelak AN, Quattrochi J, Hobson JA. A cholinoceptive desynchronized sleep induction zone in the anterodorsal pontine tegmentum: spontaneous and drug-induced neuronal activity. Neuroscience 1990b;39:295-304.
- Vanni-Mercier G, Sakai K, Lin JS, Jouvet Mapping of cholinoceptive brainstem structures responsible for the generation of paradoxical sleep in the cat. Arch Ital Biol 1989;127:133-164.
- Vanni-Mercier G, Sakai K, Jouvet M. Carbachol microinjections in the mediodorsal pontine tegmentum are unable to induce paradoxical sleep after caudal pontine and prebulbar transections in the cat. Neurosci Lett 1991;130:41-45.
- Jouvet M, Michel F. Corrélations électromyographiques du sommeil chez le chat décortiqué et mésencephalique chronique. C R Soc Biol (París) 1959;153:422-425.
- Mikiten T, Niebyl P, Hendley EEG desynchronization during behavioral sleep associated with spike discharges from the thalamus of the cat. Fed, Proc Am Soc Exp Biol 1961;20:327.
- Mouret JR, Jeannerod M, Jouvet M. L’activité électrique du système visuel au cours de la phase paradoxale du sommeil chez le J Physiol (París) 1963;55:305-306.
- Jeannerod M. Organization de l’activité électrique phasique du sommeil Lyon: Thèse de Médecine; 1965.
- Bizzi E, Brooks Functional connections between pontine reticular formation and lateral geniculate nucleus during sleep. Arch Ital Biol 1963;101:666-680.
- Brooks DC, Bizzi E. Brain stem electrical activity during deep sleep. Arch Ital Biol 1963;101:648-665.
- Roffwarg HP, Adrian J, Marks GA, Farber J. Central and peripheral REM sleep activity in the auditory system of the cat. En: Chase MH, Kripke DF, Walter PJ (eds.). Sleep Los Angeles: UCLA; 1979.
- Cespuglio R, Laurent JP, Jouvet M. Etude des relations entre l’activité ponto géniculo occipitale (PGO) et la motricité oculaire chez le chat sous réserpine. Brain Res 1975;83:319-335.
- Cespuglio R, Laurent JP, Calvo JM. Organisation anatomique des activités phasiques provoquées par la réserpine au niveau du système oculo Electroenceph Clin Neurophysiol 1976;40:12-24.
- Papez A proposed mechanisms of emotion. Arch Neurol Psychiatr 1937;38:725-743.
- McLean PD. Psychosomatic desease and the “visceral brain”: recent developments behaving on Papez theory of Psychosom Med 1940;11:338-353.
- Isaacson RL. The limbic system. New York: Plenum Press; 1974; pp.1-
- Doane BK, Livingston The limbic system. New York: Raven Press; 1986.
- Baleydier C, Mauguiere The duality of the cingulate gyrus in monkey: neuroanatomical study and functional hypothesis. Brain 1980;103:525-554.
- Kaada BR. Cingulate, posterior orbital, anterior insular and temporal pole En: Field J, Magoun HW, Hall VE (eds.) Handbook of physiology. Washington, DC: American Physiological Society; 1960.
- Escobedo F, Fernández Guardiola A, Solís H. Chronic stimulation of the cingulum in humans with behavioral En: Laitinen LV, Livingston KE (eds.). Surgical approaches in psychiatry. Lancaster: Medical and Technical Publishing; 1973; pp.65-68.
- Bancaud J, Talairach J, Geier S, Bonis A et al. Manifestations comportamentales induites par la stimulation électrique du gyrus cingulaire antérieur chez l’homme. Rev Neurol (París) 1976;132:705-724.
- Jouvet M. Paradoxical sleep. A study of its nature and mechanisms. En: Akert K, Bally C, Shadé JP (eds.). Progress in brain Vol.
- Sleep mechanisms. Amsterdam: Elsevier; 1965; pp.20-62.
- Bennett TL, Nunn PJ, Inman Effects of scopolamine on hippocampal theta and correlated discrimination performance. Physiol Behav 1971;7:451-454.
- Black AH. The operant conditioning of central nervous system electrical activity. En: Bower GH (ed.). The psychology of learning and Vol. 6, New York: Academic Press; 1972.
- Elazar Z, Adey WR. Spectral analysis of slow frequency components in the electrical activity of the hippocampus during learning. Electroenceph Clin Neurophysiol 1967;23:225-240.
- McLean PD, Delgado JMR. Electrical and chemical stimulation of fronto temporal portion of limbic system in the waking animal. Electroenceph Clin Neurophysiol 1953;5:91-100.
- Kaada BR, Jansen JJr, Andersen Stimulation of the hippocampus and medial cortical areas in unanesthetized cats. Neurology 1953;3:844-857.
- Phillips RG, LeDoux Differential contribution of amygdala and hippocampus to cued and contextual fear conditioning. Behav Neurosci 1992;106:274-285.
- Brazier MAB. Stimulation of the hippocampus in man using implanted electrodes. En: Brazier MAB (ed.). RNA and brain function, memory and Berkely: University of California Press; 1966.
- Halgren E, Walter RD, Cherlow DG, Crandall Mental phenomena evoked by electrical stimulation of the human hippocampal formation and amygdala. Brain 1978;101:83-117.
- Price JL, Russchen FT, Amaral DG. The limbic region. II: The amygdaloid En: Bjorklund A, Hokfelt T, Swanson LW (eds.). Handbook of chemical neuroanatomy. Vol. 5. Integrated systems of the CNS. Part I, Hypothalamus, hippocampus, amygdala, retina. Amsterdam, New York, Oxford: Elsevier; 1987.
- Davis M. The role of the amygdala in conditioned fear. En: Aggleton JP (ed.). The amygdala: Neurobiological aspects of emotion, memory, and mental New York: Wiley Liss; 1992.
- LeDoux JE. Emotion and the amygdala. En: Aggleton JP (ed.). The amygdala: Neurobiological aspects of emotion, memory, and mental New York: Wiley Liss; 1992.
- Amaral DG, Price JL, Pitkanen A, Carmichael ST. Anatomical organization of the primate amygdaloid complex. En: Aggleton JP (ed.). The amygdala: Neurobiological aspects of emotion, memory, and mental New York: Willey Liss, Inc.; 1992.
- Kaada BR. Stimulation and regional ablation of the amygdaloid complex with reference to functional En: Eleftheriou BE (ed.) The neurobiology of the amygdale. New York: Plenum Press; 1972.
- Penfield WP, Jasper HH. Epilepsy and the functional anatomy of the human Boston: Little Brown & Co.; 1954.
- Hodoba D. Paradoxic sleep facilitation by interictal epileptic activity of right temporal Biol Psychiatr 1986;21:1267-1278.
- Hodoba D. Evidence from epileptic patients on the role of the right hemisphere in REM Neurol Croat 1992;41:99-116.
- McCarley RW, Winkelman JW, Duffy FH. Human cerebral potentials associated with REM sleep rapid eye movement: links to PGO waves and waking potentials. Brain Res 1983;274:359-364.
- Miyauchi S, Takino R, Fokuda H, Torii S. Electrophysiological evidence of dreaming: human cerebral potentials associated with rapid eye movements during REM sleep. Electroenceph Clin Neurophysiol 1987;66:383-391.
- Niiyama Y, Shimizu T, Abe M, Hishikawa Y. Phasic EEG activities associated with rapid eye movements during REM sleep in Electroenceph Clin Neurophysiol 1988;70:396-403.
- Miyauchi S, Takino R, Fukuda H, Torii Evidencia electrofisiológica del sueño: Potenciales asociados con el sueño REM en humanos. En: Buela Casal G, Navarro Humanes JF (eds.). Avances en la investigación del sueño y sus trastornos. Madrid: Siglo Veintiuno de España Editores, S.A.; 1990; pp.195-206.
- Moruzzi G, Magoun HW. Brain stem reticular formation and activation of the EEG. Electroenceph Clin Neurophysiol 1949;1:455-473.
- Steriade M, Sakai K, Jouvet Bulbo thalamic neurons related to thalamocortical activation processes during paradoxical sleep. Exp Brain Res 1984;54:463-375.
- Rivera-García AP, Ramírez-Salado I, Corsi-Cabrera M, Calvo JM. Facial muscle activation during sleep and its relation to the rapid eye movements of REM J Sleep Res 2011;20:82-91.
- Moruzzi G. The sleep waking cycle. En: Jouvet M, Moruzzi G (eds.). Neurophysiology and neurochemistry of sleep and wakefulness. Heidelberg, New York: Reviews of Physiology; 1972.
- Penfield WP, Rasmussen T. The cerebral cortex of man. New York: Macmillan; 1950.
- Laurent JP, Cespuglio R, Jouvet M. Délimitation des voies ascendentes de l’activité ponto géniculo occipitale chez le chat. Brain Res 1974;65:29-52.
- Nielsen TA, Mcgregor DL, Zadra A, Ilnicki D et al. Pain in dreams. Sleep 1993;16:490-498.
- Dusan Peyrethon J, Peyrethon J, Jouvet Étude quantitative des phénomènes phasiques du sommeil paradoxal pendant et après sa déprivation instrumentale. C R Soc Biol 1967;161:2530-2533.
- Foote SL. Compensatory changes in REM sleep time of cats during ad libitum sleep and following brief REM sleep deprivation. Brain Res 1973;54:261-276.
- Horne JA, McGrath MJ. The consolidation hypothesis for REM sleep function: Stress and other confounding A review. Biol Psychol 1984;18:165-184.
- Smith C, Kelly G. Paradoxical sleep deprivation applied two days after end of training retards Physiol Behav 1988;43:213-216.
- Trillet Neurobiology of memory. Encephale 1992;18:295-303.
- Rotenberg VS. Sleep and memory. 1. The influence of different sleep stages on Neurosci Biobehav Rev 1992;16:497-502.
- Winson J. The biology and function of rapid eye movement sleep. Curr Opin Neurobiol 1993;3:243-248.
- Smith CT, Young Reversal of paradoxical sleep deprivation by amygdaloid stimulation during learning. Physiol Behav 1980;24:10351039.
- Smith C, Lapp L. Increases in number of REMS and REM density in humans following an intensive learning Sleep 1991;14:325-330.
- Sperry The great cerebral commisure. Sci Am 1964;210:42-52.
- Hobson JA. REM sleep and dreaming: towards a theory of protoconsNat Rev Neurosci 2009;10:803–813.
- Solms M, Turnbull The brain and the inner world. An introduction to the neuroscience of subjective experience. Londres y New York: Other/Karnac; Other Press; 2002.
- Domhoff GW. Refocusing the neurocognitive approach to dreams: a critique of the Hobson versus Solms Dreaming 2005;15:3–20.